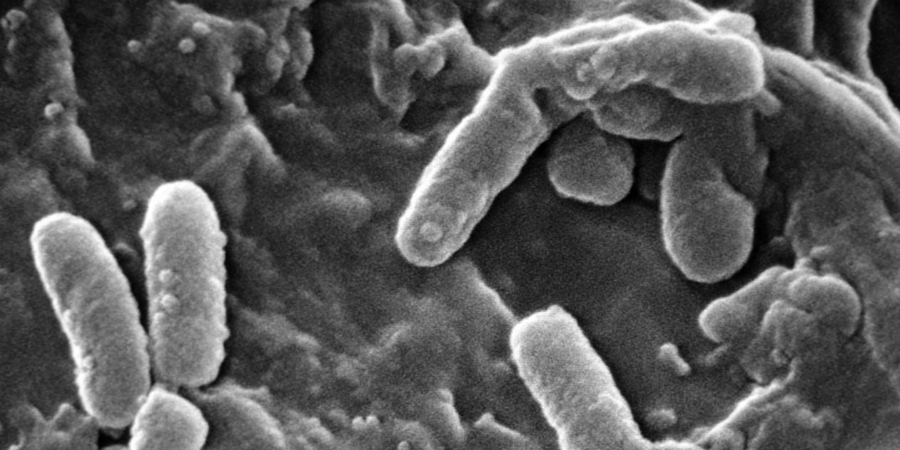
Onderzoekers ontdekten een nieuwe manier waarop bacteriën de werking van antibiotica kunnen omzeilen – met behulp van magnesiumionen.
Het is een flink probleem; bacteriën die in de loop der jaren ongevoelig zijn geworden voor antibiotica. Door deze resistentie werken sommige van de vroegere ‘wondermiddelen’ niet meer op de ziektemakers en dat kan desastreuze gevolgen hebben voor de volksgezondheid. Het is dus geen wonder dat men hard werkt aan nieuwe manieren om deze schadelijke bacteriën te bestrijden.
Ook onderzoekers aan de UC San Diego dragen een steentje bij. Het team ontdekte een nieuwe manier waarop de ziektemakers de werking van antibiotica omzeilen. In hun onderzoek, dat werd gepubliceerd in vakblad Cell, beschrijven ze hoe bacteriën door de opname van magnesiumionen te reguleren essentiële onderdelen van de ‘antibioticadood’ redden. De ontdekking zou volgens de onderzoekers bij kunnen dragen aan de ontwikkeling van nieuwe, bacterie-dodende geneesmiddelen.
Lees ook: Kunnen we bacteriofagen gebruiken als antibiotica?
Bacterie-doders
Er zijn pakweg twee soorten antibiotica; bacterie-dodende en bacterie-remmende antibiotica. Hoewel ze anders werken, kunnen beide soorten afrekenen met bacteriële infecties door te knoeien met belangrijke interne mechanismen. Zo tasten ze bijvoorbeeld de celwand aan, rommelen ze met het vermogen van de bacteriën zich te vermeerderen of liggen ze dwars bij de stofwisseling.
Helaas (voor ons) zijn sommige bacteriën in staat zich in meer of mindere mate tegen deze aanvallen te verdedigen. Dat doen ze bijvoorbeeld door de schade die de antibiotica aanricht razendsnel te repareren of alternatieve mechanismen aan te wenden om de cruciale taken van beschadigde onderdelen op te vangen.
Een simpele weergave van een doorsnee bacterie.
‘Membraandruk’
Het nieuwe onderzoek beschrijft de ontdekking van zo’n, nog niet eerder bekend verdedigingsmechanisme. Het team zag dat bacteriën hun ribosomen – onderdelen van de cel die essentieel zijn voor de productie van eiwitten – na een ‘antibiotica-aanval’ konden stabiliseren met behulp van magnesiumionen.
Ten grondslag aan deze verdediging ligt het membraanpotentiaal. Dat werkt als volgt. Alles wat een bacteriecel nodig heeft, bevindt zich in het cytoplasma. Dit ‘mengsel’ van vloeistof, celonderdelen en andere stoffen, wordt omgeven door een semi-doorlaatbaar celmembraan en een celwand. Zo’n cel wil altijd dat zowel de concentratie van stoffen, als de elektrische lading aan beide kanten van dat membraan gelijk zijn. Doordat bepaalde deeltjes dus graag naar de andere kant van het membraan willen, staat er een soort druk op. Deze druk, oftewel het verschil tussen de lading en concentratie deeltjes aan buiten- en binnenkant van de cel, heet het elektrochemisch membraanpotentiaal.
Magnesiumionen
“Het onderzoek heeft een bijzondere relatie tussen hyperpolarisatie van de membraanpotentiaal en het functioneren van het ribosoom aan het licht gebracht”, vertelt hoogleraar microbiologie Arnold Driessen (Rijksuniversiteit Groningen). Hyperpolarisatie houdt in dat het ladingsverschil tussen de binnen- en buitenkant van de cel heel groot is; binnen veel negatiever dan buiten. Dat is meestal slecht voor een cel. Driessen: “Hyperpolarisatie is het gevolg van een verminderde ionenstroom over het membraan. Als gevolg verandert de ionensamenstelling in het cytoplasma, wat weer een (negatief) effect heeft op de werking van het ribosoom.”
Uiteindelijk relateerden de onderzoekers deze hyperpolarisatie aan een verminderde stroom positief geladen magnesiumionen. “Een verhoogde magnesiumstroom kan hyperpolarisatie voorkomen”, legt Driessen uit. En dat is goed – voor de bacterie.
Magnesiumionen zouden ribosomen redden van de ‘antibiotica-dood’. © Leticia Galera-Laporta/Universitat Pompeu Fabra
“De onderzoekers zagen onder andere de levensvatbaarheid toenemen wanneer ze sub-dodelijk concentraties van op het ribosoom werkende antibiotica toevoegden”, vertelt Driessen. “Op een of andere manier neemt de hoeveelheid magnesiumtransportsystemen (membraanonderdelen die de stroom van magnesium vereenvoudigen red.) toe in de aan antibiotica blootgestelde cellen”, legt de microbioloog uit. Verhoogd magnesium zorgt dus waarschijnlijk voor een betere werking van het ribosoom, en omzeilt zo de negatieve werking van het antibioticum.
Geneesmiddelen
“Een mooi, complex artikel”, vindt Driessen het. “Het geeft een vernieuwde kijk op hoe cellulaire processen met elkaar in verband staan.” Hoewel het duidelijk is dat ribosoomactiviteit en een verhoogde magnesiumconcentratie hand in hand gaan, meent de microbioloog dat die positieve ionen vermoedelijk ook een effect hebben op allerlei andere processen.
Volgens de onderzoekers draagt de vondst bij aan de zoektocht naar nieuwe geneesmiddelen tegen bacteriële infecties. En niet per se from scratch. Ook bestaande middelen zouden met dit verdedigingsmechanisme in het achterhoofd, zo aangepast kunnen worden dat de magnesiumionen de bacterie niet te hulp kunnen schieten.
Bronnen: Cell, EurekAlert!
Beeld: Wikimedia, CC; Leticia Galera-Laporta/Universitat Pompeu Fabra
 Ben je geïnteresseerd in de wereld van wetenschap & technologie en wil je hier graag meer over lezen? Bestel dan hier ons nieuwste nummer. Abonnee worden? Dat kan hier!
Ben je geïnteresseerd in de wereld van wetenschap & technologie en wil je hier graag meer over lezen? Bestel dan hier ons nieuwste nummer. Abonnee worden? Dat kan hier!