Door te bloedtoevoer van tumoren af te sluiten, zijn DNA-robots erin geslaagd om kankergezwellen uit te schakelen.
De huidige behandelingen voor kanker – waaronder chemotherapie en straling – zijn in veel gevallen succesvol, maar zorgen ook voor een hoop bijwerkingen. Niet alleen de kwaadaardige cellen worden namelijk vernietigd, ook gezonde cellen die het lichaam hard nodig heeft, worden gedood.
Daarom zijn onderzoekers naarstig op zoek naar manieren om heel gericht tumorcellen dood te maken, terwijl de gezonde cellen intact blijven. En ‘nanorobots’ gemaakt van DNA die kankercellen aanvallen, zouden wel eens een effectieve optie kunnen zijn. Dat hebben wetenschappers van de Arizona State University onlangs aangetoond in muizen.
DNA-buisjes
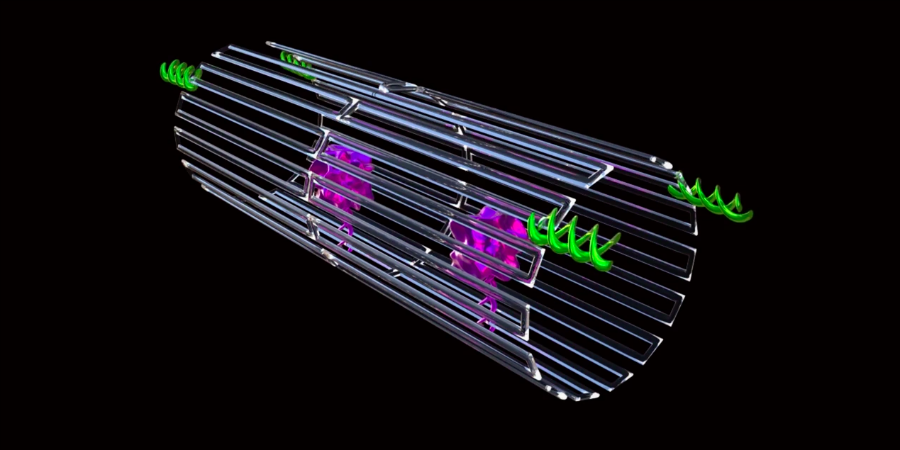
De methode werkte als volgt. Elke nanorobot was gemaakt van een plat, rechthoekig DNA-origamivel van 90 bij 60 nanometer groot. Het DNA hadden de onderzoekers van een virus genomen. Aan het oppervlak van het origamivel was een belangrijk bloedstollend eiwit – trombine genaamd – gehecht. Elk vel bevatte vier trombinemoleculen.
Het origamivel werd daarna opgerold tot een kleine buis, zodat de trombinemoleculen aan de binnenkant beschermd zaten. Aan de uiteinden van die DNA-buis (oftewel de nanorobot) bevestigden de onderzoekers kleine stukjes DNA die specifiek bonden aan een molecuul in tumorcellen, zogeheten tumor-associated molecules. De DNA-stukjes dienden dus als een soort gids voor de nanorobots.
Kleine hartaanval
De bedoeling is dan dat, zodra de nanorobots in de bloedbaan zijn gebracht, ze snel hun weg vinden naar de tumoren (dankzij de DNA-gidsen). Vervolgens zullen de nanorobots zich dan hechten aan de kankercellen, waardoor de buis zich opent en de trombinemoleculen vrijkomen.
Trombine kan de bloedtoevoer naar de tumor blokkeren door het bloed in de vaten (naar de kwaadaardige cel toe) te laten stollen, zodat er klonten ontstaan. Hierdoor komt een soort minihartaanval tot stand in de tumor en dat leidt tot de dood van de kankercel.
Geen klontjes
De methode werd getest in muizen met menselijke borstkankertumoren. Binnen 48 uur slaagden de DNA-botjes erin om bloedstolling te induceren in de vaten naar de tumoren toe. De kwaadaardige cellen kregen hierdoor geen bloed meer (en dus geen voedingsstoffen) en stierven af.
Opmerkelijk was dat de nanorobots geen bloedklonten in andere delen van het lichaam veroorzaakten, melden de onderzoekers. Alleen op de plekken waar de tumoren zich bevonden, zoals ze geprogrammeerd waren om te doen.
De wetenschappers toonden ook aan dat de bots geen stolling veroorzaakten in de gezonde weefsels van Bama-miniatuurvarkens (genetisch gemodificeerde varkens die klein blijven).
Complex
Steven de Jong (onderzoeker naar kanker aan het Universiteit Medisch Centrum Groningen) vindt de nanorobots een interessante methode, maar ook een ingewikkelde. “Voor het afleveren van specifieke anti-kankermiddelen in tumorcellen kun je ook gebruikmaken van andere methodes, zoals antilichamen gericht tegen een eiwit dat in hoge mate voorkomt op kankercellen. Dit wordt nu al toegepast in patiënten met een bepaalde vorm van borstkanker. Dat vind ik een directere aanpak dan deze complexe nanorobots.”
Ook Frank Kruyt (die onderzoek doet naar kanker aan het UMCG) is enthousiast over het onderzoek. “Het is een elegante en veelbelovende nieuwe manier om anti-kankermiddelen, die normaal gesproken te veel bijwerkingen geven, toch te kunnen toepassen als geneesmiddel. Er is nog wel het nodige vervolgonderzoek nodig voordat de nanorobot-methode kan worden toegepast in patiënten.”
“Maar als het mogelijk zou zijn om anti-kankergeneesmiddelen specifiek bij de tumor te brengen en zodanig dat alleen daar het middel zijn toxische effect heeft, dan is er geen risico op ernstige bijwerkingen en zou het middel toch in patiënten kunnen worden gebruikt.”
Bronnen: Nature Biotechnology, Science Daily, Tech Crunch, Engadget
Lees ook:
 Ben je geïnteresseerd in de wereld van wetenschap & technologie en wil je hier graag meer over lezen? Bestel dan hier ons nieuwste nummer. Abonnee worden? Dat kan hier!
Ben je geïnteresseerd in de wereld van wetenschap & technologie en wil je hier graag meer over lezen? Bestel dan hier ons nieuwste nummer. Abonnee worden? Dat kan hier!