Diverse varkensmoeders waren 28 dagen zwanger van embryo’s met nieren die voor de helft menselijk waren. En dat bleek een succes.
In Nederland sterven er jaarlijks rond de tweehonderd patiënten die op de wachtlijst stonden voor een donororgaan. Zou orgaankweek in dieren dé oplossing kunnen zijn? Onderzoekers werken hard aan technieken om dit mogelijk te maken. Nu hebben wetenschappers van het Guangzhou Institute of Biomedicine and Health (China) een mooie mijlpaal op dit gebied bereikt: ze zijn er als eerste ter wereld in geslaagd een vast (deels) menselijk orgaan te laten ontwikkelen in varkens. Ze schrijven erover in Cell Stem Cell.
Lees ook:
- Hoe varkens het tekort aan donororganen kunnen tegengaan
- Primeur: mens-schap-hybriden gecreëerd
- Embryo met cellen van mens en varken gemaakt
Chimeer-organen
Bij interspecific blastocyst complementation worden (menselijke) stamcellen – cellen die zich nog kunnen ontwikkelen tot elk type cel – geïnjecteerd in bevruchte dierlijke eicellen. Je krijgt dan zogenoemde chimeer-organen, organen die deels menselijk en deels dierlijk zijn. De bedoeling is dat ze uiteindelijk uitgroeien tot transplanteerbare organen. Zie hieronder hoe dat zou werken.
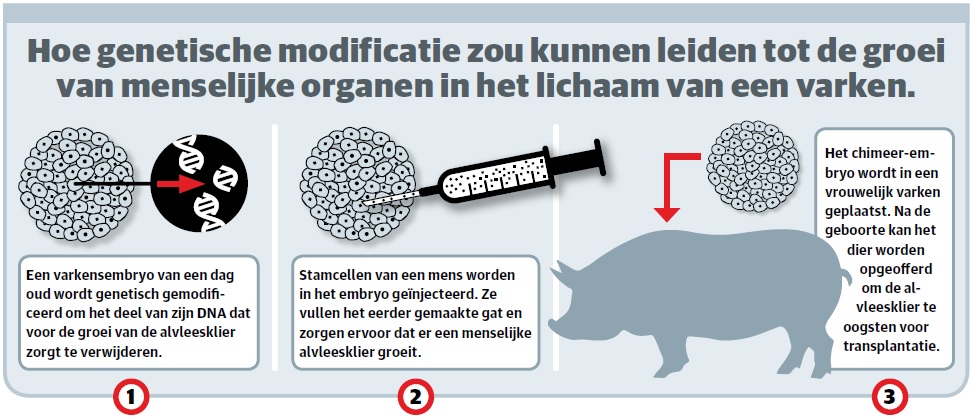
Maar zover zijn we nog lang niet. Liangxue Lai en zijn team zorgen nu wel voor een stap voorwaarts. Ze focusten zich op de nieren. Deze organen ontstaan al vroeg in de ontwikkeling in de baarmoeder. Daardoor kunnen wetenschappers de gemaakte chimeer-embryo’s makkelijker onderzoeken. Bovendien staan de nieren bovenaan het lijstje van meest gewilde donororganen.
Nieuw stappenplan
Integratie van menselijke cellen in een dierlijk embryo is lastig, omdat ze vaak de competitie verliezen van de dierlijke cellen. De huidige onderzoekers hebben dit probleem de afgelopen jaren uitgebreid onderzocht en komen nu met een nieuw stappenplan voor het creëren van chimeer-nieren in varkens.
Stap een is het maken van ruimte (een zogenoemde niche) voor de menselijke cellen. Via de DNA-knip-en-plak-techniek CRISPR verwijderden Lai en collega’s in de bevruchte varkenseicel (die dan nog uit één cel bestaat) de genen die zorgen voor nierontwikkeling. Zo wordt het de varkenscellen lastig gemaakt om niercellen te worden en belemmeren ze minder de transformatie van de menselijke stamcellen tot niercellen.
Dertien varkensmoeders
In stap twee worden de menselijke stamcellen genetisch aangepast. De wetenschappers zorgden ervoor dat ze zich fijner zouden voelen in de ‘vijandige’ omgeving van het varkensembryo en minder snel dood zouden gaan.
Daarna volgt de stap waarbij de chimeer-embryo daadwerkelijk wordt gemaakt. Lai en zijn team brachten de menselijke en varkenscellen bij elkaar in een speciaal goedje waarin stoffen zaten waarbij beide soorten cellen (die verschillende behoeftes hebben) zich prettig voelden.
In totaal ontstonden er op deze manier 1820 chimeer-embryo’s. In de laatste stap werden die ingebracht in de baarmoeders van dertien surrogaat-varkensmoeders. Na 25 of 28 dagen braken de onderzoekers de zwangerschap af. Vijf embryo’s werden vervolgens onder de microscoop bekeken.
Half menselijk
De embryo’s bleken mooie nieren te hebben gekregen. Zo’n 50 tot 60 procent van de organen bleek menselijk te zijn. Die menselijke cellen vormden onder meer nierbuisjes, die belangrijk zijn voor de nierfunctie (afvalstoffen uit het bloed zuiveren) en een begin van de urineleiders (de buisjes die de geproduceerde urine naar de blaas brengen). De nieren waren in de zogenoemde mesonephros-fase van de ontwikkeling. Dit is precies volgens verwachting na 25 tot 28 dagen sinds de implantatie.
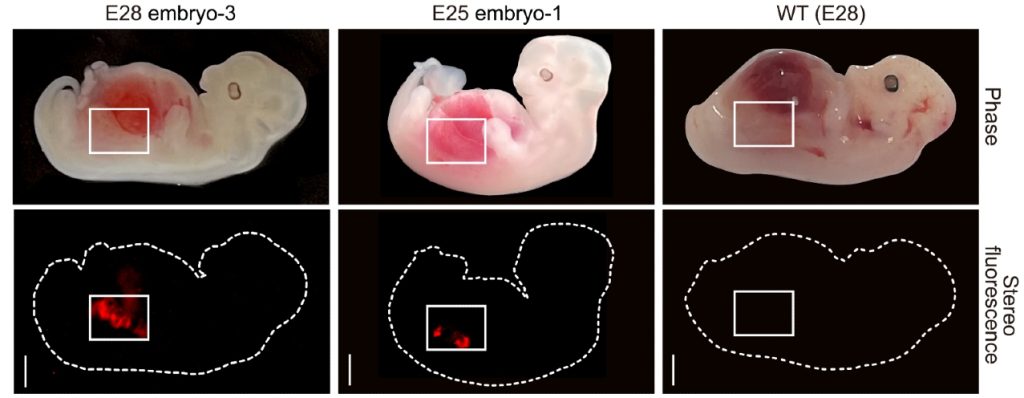
Lai en collega’s denken dat vooral het creëren van de niche voor de menselijke stamcellen het recept was voor hun succes. Ze denken dan ook dat nog meer niergenen uitschakelen in de bevruchte varkenseicel gaat helpen om een nóg groter aandeel menselijke niercellen te verkrijgen.
Ethische dillema’s
Een ander punt van aandacht is de kans op verspreiding van menselijke cellen in de rest van het varkensembryo. Uit het onderzoek blijkt dat enkele van die cellen zich in het ontwikkelende varkensbrein en -ruggenmerg hebben genesteld.
Dat is al best netjes, zeggen Lai en collega’s, maar het kan én moet nog minder. Je wilt er tenslotte niet aan denken dat er ooit een biggetje wordt geboren met deels menselijke eigenschappen. Door nog meer genetisch aanpassingen aan zowel de menselijke als de varkenscellen kunnen deze ethische dillema’s mogelijk (deels) worden opgelost.
Nog maar ‘half af’
Gesterkt door het succes, staan de onderzoekers alweer te trappelen om hun volgende mijlpaal te behalen: het maken van (deels) menselijke harten en alvleesklieren in varkens. Want ook aan dit soort organen is grote nood bij mensen.
Voordat we overigens dit soort kweekorganen daadwerkelijk kunnen gebruiken voor transplantatie zijn er nog wat heel hobbels te nemen. Volledige functionele organen bestaan uit meerdere typen cellen met elk hun eigen taak. De nu gemaakte nieren waren nog maar ‘half af’. Genoeg werk aan de winkel dus. Tot die tijd kan de nu ontwikkelde techniek worden ingezet voor de bestudering van embryo-ontwikkeling en mogelijke stoornissen daarin.
“Een interessant onderzoek dat het veld nog een stap verder brengt in het doel om menselijke organen te maken in varkens door middel van chimere generatie”, geeft ontwikkelingsbioloog Christine Mummery van het LUMC aan. “Probleem is nog wel dat de bloedvaten in de humane nier nog van het varken zijn, waardoor het orgaan kan worden afgestoten na transplantatie. Een aantal (andere) groepen proberen dit op te lossen. Verder is in deze studie nog niet onderzocht of de nier het einde van de zwangerschap haalt.”
Bronnen: Cell Stem Cell, Cell Press via EurekAlert!
Beeld: Neumann & Rodtmann/Getty Images